L’emicrania è un disturbo neurologico complesso caratterizzato da un dolore unilaterale e pulsatile avvertito in corrispondenza del cranio.
Colpisce decisamente di più il sesso femminile ed è fortemente debilitante.
Esistono diverse ipotesi alla base di questo disturbo, le più accreditate sono quelle neurologiche e quelle vasali.
In ogni caso alla base di questi disturbi sembra esserci un ipometabolismo del glucosio in alcune aree dell’encefalo.
Su questa base si spiega come spesso diete che rendano disponibile energia in altre forme all’encefalo abbiano portato e portino spesso risultati entusiasmanti.
Nella fattispecie le diete chetogeniche (KD) sembrano essere in grado di contrastare la cronicità degli eventi di dolore.
Questo accadrebbe per vari motivi:
- il Betaidrossibutirrato (BHB) prodotto in maniera endogena durante una KD è in grado di aumentare il metabolismo dei mitocondri, iperpolarizzare le membrane eccitabili (con conseguente riduzione dell’eccitabilità di queste ultime), ridurre la produzione di specie reattive dell’ossigeno
- stabilizzare i picchi insulinemici e glicemici, causa spesso di deficit di apporto cerebrale di glucosio anche in chi non è affetto da emicranie
- favorire l’espressione di recettori GABA a livello centrale (calmanti, parasimpatico) piuttosto che per il Glutammato (eccitatorio, ortosimpatico)
Chiaramente tutto questo va definito in un contesto personalizzato. Spesso semplicemente limitando alcuni tipi di alimenti si può comunque raggiungere un miglioramento del disturbo.
Cibi contenenti glutammato monosodico ( brodi, proteine in polvere idrolizzate, estratti di lievito) andrebbero evitati
Andrebbe ridotto l’apporto di caffeina da caffè, cioccolato, coca cola
La Tiramina funge da precursore dell’istamina, che un vasodilatatore a livello centrale. Cibi contenenti tiramina (carni processate, formaggio, vino rosso) andrebbero limitati, così come quelli che contengono nitrato di sodio come conservante e aspartame
La moderna medicina si avvale di studi scientifici di biochimica, biofisica e neurofisiopatologia dell’organismo umano che forniscono una idea dello stato di salute della persona come un equilibrio di più sistemi al fine di inquadrare il soggetto in maniera completamente personale, in una ottica di prevenzione più che di cura di una specifica malattia o di un sintomo particolare.
Questo perché ai nostri giorni sono le complesse patologie e sindromi che caratterizzano l’epoca in cui viviamo e la quotidianità delle nostre frenetiche vite a portare il soggetto a ricercare una risoluzione che abbia questo tipo di approccio.
In tutti questi disturbi la ricerca ha portato ad identificare come soggetto unificante la cosiddetta “infiammazione cronica di basso grado”.
Il nostro ipotalamo si occupa di elaborare tutti i tipi di informazione che si ricevono, coscienti e non coscienti, fisici ed emotivi, con lo scopo di preservare la funzionalità del nostro organismo. Induce pertanto a seguito di uno stress l’ipofisi a liberare una cascata di molecole che si comportano come ormoni o come citochine(specifici segnalatori del sistema immunitario) o neurotrasmettitori. Una volta attivato questo asse stimolerà direttamente il surrene con attivazione di ormoni che permettono una risposta di adattamento dell’organismo a una condizione potenzialmente pericolosa.
Da qui la necessità di distinguere due tipi di stress:
- uno stress acuto, porta ad una attivazione del sistema in una ottica “salvavita”
- uno stress cronico, che porterà a una risposta non più efficace e salvavita ma afinalistica e di sovvertimento patologico dei sistemi. Questa liberazione di molecole, in tal caso, corrisponderà alla condizione di infiammazione cronica silente d basso grado, che potrà comportare per attivazione cronica a patologie cardiovascolari, ipertensione, ulcere, sovrappeso, malnutrizione, neuroinflamaging, disbiosi intestinale, alterazioni dell’umore, delle funzioni cognitive.
In questa ottica un evento specifico periferico come una emozione, uno stato metabolico ottimale, uno stato fisico muscolare riequilibrato, uno stato ormonale riequilibrato diventerà fonte di riequilibrio degli altri sistemi .
Il dott. Mark Mattson, direttore del laboratorio di neuroscienze presso la John Hopkins University è uno dei più importanti ricercatori nel campo dei meccanismi cellulari e molecolari alla base di molte malattie neuro degenerative, come il Parkinson e il morbo d’Alzheimer.
È noto da molto tempo che i cambiamenti della dieta possano influenzare il funzionamento cerebrale. La sovralimentazione può inficiare l’attività dell’ipotalamo, che svolge un ruolo fondamentale per il controllo del bilancio energetico dell’organismo. Uno studio sul digiuno intermittente, ovvero i digiunare per periodi brevi di tempo, ha messo in evidenza come è in grado di migliorare memoria e apprendimento e di ridurre i rischi di degenerazione delle funzioni cerebrali.
Sia il digiuno che l’esercizio fisico, infatti aumentano il numero di mitocondri (ossia gli organelli cellulari deputati alla produzione di energia) nei neuroni. In questo modo non solo migliora a funzione cognitiva, ma aumenta la resistenza allo stress e riduce le infiammazioni.
Durante una restrizione calorica o un digiuno vero e proprio, viene ammantata la produzione di una proteina detta fattore neurotofico (BDNF) che si pensa sia la chiave della produzione di mitocondri.
Inoltre on pochi studi affermano come lo stesso digiuno abbia effetti incredibili anche sulla protezione del sistema immunitario, stimolando il rinnovamento delle cellule deputate a questa funzione.
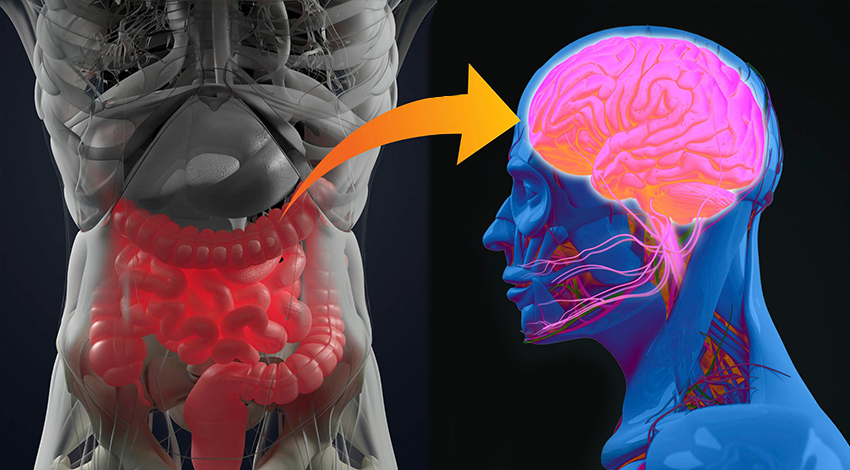
Partendo dall’intuizione dell’anatomopatologo tedesco Braak, un gruppo di ricercatori della Johns Hopkins ha messo a punto un modello murino, che l’ha confermata in pieno. Il Parkinson avrebbe origine nell’intestino, dove si formerebbero aggregati della proteina patologica alfa-sinucleina che poi risalirebbero, come per una scala, sfruttando le terminazioni dal nervo vago, verso le aree cerebrali dove si trovano i neuroni produttori di dopamina (subtantia nigra), determinandone così la morte. Riuscire a bloccare la risalita di queste proteine verso il cervello nelle fasi precoci di malattia, potrebbe significare prevenire o arrestare la progressione del Parkinson
La notizia viene da uno studio pubblicato su Neuron a firma di Sangjune Kim e colleghi del Johns Hopkins Medicine ed è rivoluzionaria. Alcuni esperimenti condotti su modelli animali (topi) dimostrano che il Parkinson origina da alcune cellule dell’intestino, per poi risalire, attraverso il nervo vago, fin nel cervello per andare a colpire i neuroni produttori di dopamina. Questa straordinaria evidenza offre alla scienza un modello accurato e innovativo sul quale testare trattamenti che potrebbero prevenire o arrestare la progressione di questa malattia.
“Questo studio – afferma Ted Dawson, direttore del Johns Hopkins Institute for Cell Engineering e professore di neurologia alla Johns Hopkins – fornisce ulteriori evidenze del ruolo che l’intestino gioca nel morbo di Parkinson e costituisce allo stesso tempo un nuovo modello per studiare la progressione di questa malattia, fin dalle primissime fasi”.
Alfa-sinucleina ‘mal ripiegata’: la proteina patologica alla base del Parkinson
La caratteristica anatomopatologica del Parkinson sono gli aggregati di forme mal ripiegate della proteina neuronale alfa-sinucleina e la morte selettiva dei neuroni produttori di dopamina in una piccola regione del cervello, la pars compacta della substantia nigra. La moria dei neuroni di quest’area determina i sintomi motori del Parkinson (tremori, rigidità, movimenti rallentati, turbe dell’equilibrio, alterazioni del linguaggio e della coordinazione). Non esistono al momento terapie risolutive.
I primi studi sull’origine intestinale del Parkinson
Lo studio appena pubblicato ha le sue radici nelle ricerche del neuroanatomista Heiko Braak che nel 2003 aveva dimostrato come le persone con Parkinson presentino degli accumuli della proteina alfa-sinucleina incorrettamente ripiegata (misfolded) in alcune zone del sistema nervoso deputate al controllo dell’intestino. La comparsa di queste proteine danneggia-neuroni coincide con il riscontro di alcuni sintomi precoci del Parkinson, quali la stipsi. Braak aveva ipotizzato che la malattia di Parkinson progrediva ‘risalendo’, come lungo una scala, lungo i nervi che collegano l’intestino al cervello.
Da allora si sono andate accumulando sempre più evidenze dell’esistenza di una connessione intestino-cervello, alla base di questa malattia. Alcune ricerche hanno dimostrato che le proteine alfa-sinucleina mal ripiegate fossero in grado di risalire verso la base del cervello, attraverso il nervo vago.
Gli esperimenti della Johns Hopkins: iniezioni di alfa-sinucleina nell’intestino e resezione del nervo vago
Partendo da questa base, i ricercatori della Johns Hopkins hanno iniettato 25 microgrammi di alfa-sinucleina ‘malripiegata’ nell’intestino di una dozzina di topi in buona salute. A distanza di 1, 3 , 7 e 10 mesi dall’iniezione, i ricercatori americani sono andati ad analizzare dei campioni di tessuto cerebrale dei topi, evidenziando così che l’alfa-sinucleinasi andava accumulando nelle terminazioni intestinali del nervo vago per poi diffondersi in varie zone del cervello.
Gli autori dello studio sono andati quindi a ripetere l’esperimento (iniezione di alfa-sinucleina mal ripiegata a livello intestinale) utilizzando animali ai quali era stato reciso il nervo vago. A distanza di sette mesi, gli animali non mostravano alcun danno a livello cerebrale; la conclusione dei ricercatori è stata dunque che la recisione del nervo vago impediva la diffusione verso il cervello della proteina patogena.
In un’altra parte dell’esperimento, i ricercatori sono andati a valutare la corrispondenza tra progressione della malattia e alterazioni comportamentali, esaminando tre gruppi di animali: topi iniettati con alfa-sinucleina mal ripiegata, topi iniettati con la proteina patologica e ai quali veniva sezionato il nervo vago, gruppo di controllo (topi non iniettati e con nervo vago integro).
A distanza di sette mesi dall’iniezione di alfa-sinucleina gli autori dello studio sono andati a valutare la capacità di costruire una tana da parte degli animali, fornendo loro 2,5 grammi di materiale adatto e osservandoli per 16 ore; alla capacità ‘costruttiva’ veniva quindi assegnato un punteggio da 0 a 6. I topi iniettati e con nervo vago intatto sono risultati quelli con la peggior attitudine alla costruzione di un rifugio (il loro punteggio era costantemente inferiore a 1, mentre gli animali degli altri due gruppi totalizzavano 3 o 4); a differenza degli altri due gruppi che utilizzavano sempre tutto il materiale ‘da costruzione’ fornito, i topi iniettati con alfa-sinucleina misfolded ne utilizzavano meno di un grammo. Questo esperimento – commentano gli autori – sta a dimostrare che questi animali, esattamente come avviene nell’uomo, con la progressione della malattia presentano un deterioramento del controllo dei movimenti fini.
Un altro esperimento è andato a misurare i livelli di ansia dei topi, monitorando la loro reazione ad un nuovo ambiente. Il topo veniva posto in una grande scatola aperta dove una telecamera monitorava costantemente la loro capacità di esplorazione. I topi in salute si mostravano curiosi ed esploravano ogni parte del nuovo ambiente; quelli affetti da declino cognitivo al contrario erano più ansiosi e tendevano a rifugiarsi verso i bordi coperti della scatola, più che ad esplorarne il centro. Secondo i ricercatori anche questo tratto ansioso è caratteristico dei pazienti con Parkinson.
Le ricadute dello studio: verso una terapia per il Parkinson
I risultati di questo studio dimostrano dunque che l’alfa-sinucleina mal ripiegata nei topi si può ‘trasmettere’ dall’intestino al cervello, risalendo il nervo vago; il blocco di questa via di comunicazione potrebbe aiutare secondo gli autori di questa ricerca a prevenire le manifestazioni fisiche e cognitive del Parkinson e potrebbe dunque rappresentare un target terapeutico per le prime fasi della malattia. Resta però da scoprire quali parti del nervo vago consentono la risalita delle proteine patologiche verso il cervello e come bloccarla.
Autore: MR Montebelli – Fonte: MR Montebelli
L’influenza della frequenza e della tempistica dei pasti sulla salute e sulle malattie è stata un argomento di interesse per molti anni.
Mentre le evidenze epidemiologiche indicano un’associazione tra le più alte frequenze del pasto e il più basso rischio di malattia, prove sperimentali hanno mostrato risultati contrastanti. Inoltre, recenti ricerche prospettiche hanno dimostrato un aumento significativo del rischio di malattia con un’alta frequenza del pasto (≥6 pasti al giorno) rispetto a una bassa frequenza del pasto (1-2 pasti al giorno). Oltre alla frequenza e ai tempi del pasto, dobbiamo considerare anche il consumo della colazione e la distribuzione dell’apporto energetico giornaliero, la restrizione calorica e il consumo notturno. Un ruolo centrale in questo scenario complesso è giocato dalla durata del periodo di digiuno tra due pasti. Il sottofondo fisiologico di queste variabili interconnesse può avvenire attraverso orologi circadiani interni e il consumo di cibo asincrono con i ritmi circadiani naturali può esercitare effetti negativi sulla salute e aumentare il rischio di malattia. Inoltre, le alterazioni nella frequenza dei pasti e nei tempi dei pasti hanno il potenziale di influenzare l’assunzione di energia e macronutrienti. Un modello regolare di pasti incluso il consumo della prima colazione, consumando una più alta percentuale di energia all’inizio della giornata, riduce la frequenza del pasto (cioè 2-3 pasti al giorno ), e periodi di digiuno regolari possono fornire benefici fisiologici quali riduzione dell’infiammazione, miglioramento della ritmicità circadiana, aumento dell’autofagia e resistenza allo stress e modulazione del microbiota intestinale.
Nella cultura occidentale, è un’idea comune che l’assunzione giornaliera di cibo dovrebbe essere divisa in tre pasti quadrati: colazione, pranzo e cena. Spesso i dietologi suggeriscono di aggiungere due spuntini (mattina e pomeriggio) per aiutare il controllo dell’appetito, e in effetti il messaggio principale è quello di mangiare “da cinque a sei volte al giorno”. Tuttavia, il numero di pasti non è uno standard universale, e i tre pasti quadrati tradizionali sono, in qualche modo sorprendentemente, un comportamento recente. Ad esempio, gli antichi romani avevano solo un sostanzioso pasto, di solito consumato intorno alle 16:00 (coena), e credevano che mangiare più di una volta al giorno fosse malsano. Sebbene mangiassero anche al mattino (ientaculum) ea mezzogiorno (prandium), questi pasti erano frugali, leggeri e veloci [1]. Più tardi, le regole monastiche influenzarono il comportamento alimentare delle persone comuni. Il termine colazione significa “interrompere la notte veloce”, sottolineando che si tratta del primo pasto dopo la serata / serata dedicata alla preghiera [2]. Nei primi tempi medievali, i monaci erano obbligati a rimanere in silenzio durante i pasti, mentre uno di loro leggeva ad alta voce un testo religioso. Uno dei testi più letti è stato il Collationes (compilation) di Giovanni Cassiano, e vale la pena ricordare che il termine italiano per colazione è “colazione”, che deriva proprio dalla parola latina “collationes” [3]. Anche la colazione è diventata importante durante la rivoluzione industriale come pasto consumato prima di andare al lavoro. La cena nella sua forma attuale e il suo tempo sono diventati popolari dopo l’uso diffuso della luce artificiale, che ha facilitato il consumo prima dell’alba e dopo il tramonto [3].
Fonte: Antonio Paoli, Grant Tinsley, Antonino Bianco and Tatiana Moro